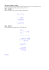Cieplo wlasciwe Cv gazu
Transkrypt
Cieplo wlasciwe Cv gazu
Ciepło właściwe Cv gazu Molowe ciepło właściwe Cv wodoru w zależności od temperatury. R – stała gazowa. Ciepło właściwe wodoru w stałej objętości (Cv) zależy od temperatury i w różnych jej zakresach przyjmuje wartości charakterystyczne dla: - gazu jednoatomowego z trzema stopniami swobody (20-100 K), - gazu dwuatomowego z 5 stopniami swobody (300-700 K), - gazu dwuatomowego z 7 stopniami swobody (powyżej 3000 K). Zależność ciepła właściwego od temperatury – dużo słabszą niż w przypadku wodoru – wykazują także inne gazy, szczególnie w niskich temperaturach. Zmienność ciepła właściwego wynika z kwantowania energii ruchu obrotowego i oscylacji (patrz: nast. strona). Energia kinetyczna ruchu postępowego cząsteczek wodoru nie podlega kwantowaniu i cząsteczki mogą ją posiadać w dowolnych ilościach, średnio po 3·(½kT). W niskich temperaturach (20-100 K) stanowi jedyną formę energii cząsteczek i dlatego gaz wykazuje ciepło właściwe 3R/2. Energia ruchu obrotowego cząsteczek wodoru pojawia się w zakresie temperatur 100-300 K i w tym zakresie ciepło właściwe wzrasta do wartości 5R/2, która odpowiada pięciu stopniom swobody cząsteczek (3 dla ruchu postępowego oraz 2 dla obrotowego). Energia oscylacyjna – kinetyczna i potencjalna – pojawia się w temperaturach 700-3000 K. Oscylacjom wewnątrzcząsteczkowym towarzyszą duże porcje (kwanty) energii; wynika stąd wzrost średniej energii cząsteczek o 2·(½kT) i wzrost molowego ciepła właściwego do 7R/2 (w cząsteczkach dwuatomowych) lub o większą wielokrotność tej wielkości. 1 Przykład: energia ruchu obrotowego cząsteczki wodoru W cząsteczce wodoru jądra obu atomów krążą po okręgu o d = 0,74 Å promieniu (½)d wokół osi pionowej (patrz: rysunek obok). Masa każdego z nich jest masą protonu mp . Energia kinetyczna cząsteczki wynosi: oś 1 2 obrotu E = Iω 2 Prawa mechaniki kwantowej stanowią, że moment pędu cząsteczki J: J = Iω (I – moment bezwładności cząsteczki) nie jest dowolny, lecz stanowi wielokrotność stałej Plancka: h J = n⋅ = nℏ (n = 0, 1, 2, 3, 4, ... ) 2π Wyznaczając prędkość kątową ω z tych dwu równań i podstawiając ją do E otrzymujemy: n 2ℏ 2 E= 2I Energia kinetyczna może zatem przyjmować wartości: ℏ2 ℏ2 ℏ2 ℏ2 0, , 4 , 9 , 16 , ... 2I 2I 2I 2I Według zasady ekwipartycji energii średnia energia ruchu obrotowego ma związek z temperaturą układu, którego część stanowi cząsteczka. Najmniejsza niezerowa ilość energii (dla n = 1) może więc wystąpić w temperaturze spełniającej warunek: ℏ2 1 ≈ kT 2I 2 Traktując powyższy warunek jako równanie, po podstawieniu: 2 d I = 2m p ⋅ = 4,6 ⋅ 10−48 kg ⋅ m 2 2 h ℏ= = 1,054 ⋅ 10 −34 J ⋅ s 2π k = 1,38 ⋅ 10−23 J / K otrzymujemy: ℏ2 T= = 176 K kI Jak widać na rysunku obok, jest to dość dobre oszacowanie temperatury, w której wyraźnie zaczyna pojawiać się ruch obrotowy molekuł wodoru, a ciepło właściwe osiąga wartość pośrednią między 3R/2 i 5R/2. W analogiczny sposób można otrzymać oszacowanie temperatury potrzebnej do wystąpienia ruchu oscylacyjnego. Wynosi ona około 2000-3000 K (przejście od 5R/2 do 7R/2). 2