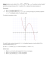MODELODPOWIEDZI do zadań na konkurs z chemii etapu
Transkrypt
MODELODPOWIEDZI do zadań na konkurs z chemii etapu
1 MODEL OD POWI EDZI do zadań na konkurs z chemii etapu wojewódzkiego w roku szkolnym 2013/2014 Zadanie 1. [0-6 pkt.] Zaprojektuj doświadczenia chemiczne, w którym otrzymasz wodorotlenek potasu oraz wodorotlenek glinu. W tym celu masz do dyspozycji odpowiednie substancje chemiczne: potas, glin, wodę, wodorotlenek sodu, tlenek glinu, chlorek glinu, chlorek potasu, fenoloftaleinę. Narysuj schematy doświadczeń, zapisz obserwacje oraz równania reakcji chemicznych w formie jonowej skróconej. a) Otrzymywanie wodorotlenku potasu: Schemat doświadczenia: potas ↓ H2O + fenoloftaleina Obserwacje: Po dodaniu 2-3 kropel fenoloftaleiny do probówki z wodą zawartość pozostaje nadal bezbarwna. Gdy wrzucimy kawałek potasu do probówki z wodą obserwujemy energicznie przemieszczający się kawałek potasu po lustrze wody, aż do momentu przereagowania z wodą (może nawet pojawić się płomień). Zawartość probówki zabarwia się na kolor malinowy. Równanie reakcji chemicznej w formie jonowej skróconej: 2 2K + 2H2O → 2K+ + 2OH- + H2 ↑ b) Otrzymywanie wodorotlenku glinu: Schemat doświadczenia: NaOH(aq) ↓ AlCl3 (aq) + fenoloftaleina Obserwacje: Po dodaniu 2-3 kropel fenoloftaleiny do probówki z roztworem chlorku glinu zawartość pozostaje nadal bezbarwna. Gdy do probówki dolejemy roztworu wodorotlenku sodu obserwujemy zabarwienie zawartości probówki na kolor malinowy oraz obserwujemy wytrącanie się osadu. Równanie reakcji chemicznej w formie jonowej skróconej: Al3+ + 3OH- → Al(OH)3 Zadanie 2. [0-4 pkt.] 2 8 8 W związku chemicznym typu XY jony mają jednakową konfigurację elektronową K L M . Pierwiastek chemiczny X w związkach chemicznych jest zawsze jednowartościowy, a pierwiastek Y może tworzyć cząsteczkę Y2. Napisz wzór sumaryczny związku chemicznego, jego nazwę systematyczną, określ rodzaj wiązania chemicznego między atomami pierwiastków X i Y oraz określ rodzaj wiązania chemicznego w cząsteczce Y2. Wzór sumaryczny związku chemicznego: KCl Nazwa systematyczna związku chemicznego: chlorek potasu Rodzaj wiązania chemicznego między atomami pierwiastków X i Y: jonowe Rodzaj wiązania chemicznego w cząsteczce Y2: kowalencyjne. 3 Zadanie 3. [0-11 pkt.] Przeprowadzono doświadczenie chemiczne wg poniższego schematu: Cu AgNO3 (aq) ↑ Na2CO3(aq) KOH(aq) + wskaźnik uniwersalny ↑ ↑ ↑ Mg NaCl(aq) ↑ ↑ HCl a) Wpisz numery probówek, w których: zajdą reakcje chemiczne: 2, 3, 4, 5 zajdzie reakcja chemiczna zgodnie z zapisem jonowym skróconym: H+ + OH- → H2O: 4 strąci się osad: 2 wydzieli się gaz: 3, 5 wydzieli się gaz cięższy od powietrza: 3 b) Zapisz obserwacje do reakcji chemicznych, które zaszły w probówkach 4 i 6: Probówka 4: Wskaźnik uniwersalny w obecności KOH zabarwiony jest na kolor niebieski, a po dodaniu całej zawartości do HCl następuje odbarwienie wskaźnika do koloru żółtego. Probówka 6: Po dodaniu roztworu NaCl do HCl nic nie zaobserwowano – reakcja nie zaszła. c) Napisz w formie jonowej skróconej równania reakcji przebiegających w probówkach 1, 2, 3 i 5: Probówka 1: Reakcja nie zaszła, miedź nie reaguje z kwasem chlorowodorowym Probówka 2: Ag+ + Cl- → AgCl ↓ Probówka 3: CO32- + 2H+ → CO2 + H2O Probówka 5: Mg + 2H+ → Mg2+ + H2 ↑ 4 Zadanie 4. [0-3 pkt.] Do probówek I i II, w których umieszczono próbki stałych substancji dodano kwasu siarkowego (VI). W probówce I substancja całkowicie przereagowała i wydzielił się bezbarwny gaz, a w probówce II nastąpiło zwęglenie substancji. a) Która z wymienionych poniżej substancji znajdowała się w probówce I, a która w probówce II: sacharoza, sól kamienna, węglan potasu, smalec? Uzupełnij tabelę. I. węglan potasu II. sacharoza b) Zapisz skrócone jonowe równanie reakcji, która zaszła w probówce I: CO32- + 2H+ → CO2↑ + H2O c) Jaka właściwość kwasu siarkowego (VI) przyczyniała się do zwęglenia substancji? higroskopijność Zadanie 5. [0-1 pkt] Wskaż poprawną odpowiedź i obok wstaw znak X. Wodę bromową można wykorzystać do odróżnienia: ❑ a) propenu od acetylenu ❑ b) kwasu oleinowego od butenu ❑ c) butanu od propanu X d) etylenu od etanu Zadanie 6. [0-1 pkt] Na podstawie poniższego rysunku uzupełnij zdanie. Wpisz w lukę nazwę wydzielającego się gazu. Gazem, który zbiera się w probówce jest eten (etylen). 5 Zadanie 7. [0-3 pkt.] Na podstawie poniższej tabeli dobierz w pary reakcje chemiczne i warunki, jakie muszą być spełnione, by dana reakcja w ogóle zaszła: Reakcje chemiczne Warunki A polimeryzacja a obecność wody B estryfikacja b obecność H+ C hydroliza c obecność wody i enzymów D spalanie d wysokie ciśnienie i katalizator (np. nikiel) E hydroliza celulozy e wysokie ciśnienie, wysoka temperatura i katalizator F uwodornienie acetylenu f obecność tlenu A - e; B - b; Zadanie 8. C - a; D - f; E - c; F – d; [0-3 pkt.] Które właściwości nie dotyczą acetylenu? Zaznacz X obok. X a) ulega tylko spalaniu całkowitemu ❑ b) bardzo słabo rozpuszczalny w wodzie ❑ X X ❑ X ❑ X c) ma właściwości narkotyczne d) ma specyficzny, łagodny zapach e) odbarwia wodę bromową, ale nie odbarwia manganianu (VII) potasu f) wybuchowy w powietrzu g) ma 1 wiązanie podwójne między atomami węgla, bo zaliczany do alkenów h) spala się kopcącym płomieniem i) cięższy od powietrza, bo ma bardzo dużą procentową zawartość węgla w cząsteczce (92,3%). Uwaga: Komisja wyeliminowała ppkt f) [można otrzymać go z acetonu] z oceniania (ten ppkt nie jest już ujęty w kluczu). Jednakże Komisja ustaliła, że wyeliminowanie tegoż podpunktu nie wpłynie na zmianę punktacji całego zadania. Liczba punktów nadal pozostaje ta sama. Zadanie 9. [0-5 pkt.] Masa cząsteczkowa pewnego kwasu karboksylowego wynosi tyle samo co masa cząsteczkowa etanolu. Podaj wzór sumaryczny, nazwę tego kwasu, zapisz równanie jego reakcji dysocjacji, równanie reakcji z wapniem w formie cząsteczkowej oraz zapisz nazwę powstałej soli. 6 - HCOOH - kwas metanowy (mrówkowy) - HCOOH → HCOO- + H+ - 2HCOOH + Ca → (HCOO)2Ca + H2 - mrówczan wapnia (metanian wapnia) Zadanie 10. [0-3 pkt.] Oblicz, ile gramów wody otrzymano w reakcji, w której całkowicie zestryfikowano 264 g kwasu masłowego z etanolem. Napisz równanie reakcji na wzorach strukturalnych i zaznacz elementy, z których powstała woda. masa 1 cząsteczki C3H7COOH = 88 g 264 g : 88 g = 3 cząsteczki kwasu masłowego uległy estryfikacji zatem: masa 1 cząsteczki H2O = 18 g 3 cząsteczki wody powstaną w reakcji x 18 g = 54 g wody H H H O H H H H H O H H │ │ │ ║ │ │ │ │ │ ║ │ │ 3 H - C – C – C- C – O – H + 3 H - C- C – O – H → 3 H - C – C – C- C – O – C- C – H + │ │ │ │ │ │ │ │ │ │ H H H H H H H H H H +3H–O–H z tych elementów powstaje woda Informacja do zadania 11 i 12. Do parowniczki wlano niewielką ilość roztworu wodorotlenku sodu z dodatkiem fenoloftaleiny. Następnie wsypano tyle kwasu stearynowego aż otrzymano gęstą papkę. Otrzymaną mieszaninę ogrzewano w płomieniu palnika przez ok. 2-3 min. Zadanie 11. [0-4 pkt.] Zakreśl kółeczkiem P, jeśli zdanie jest prawdziwe lub F, jeśli zdanie jest fałszywe. Odbarwienie roztworu wskazuje, że kwas stearynowy uległ dysocjacji tworząc kationy wodorowe, które wpłynęły na zmianę pH. P/F Odbarwienie roztworu wskazuje, że pomiędzy wodorotlenkiem sodu i kwasem stearynowym zachodzi reakcja chemiczna. P/F c) Zabarwienie roztworu wskazuje na kwasowy charakter kwasu stearynowego. P/F d) W wyniku reakcji chemicznej otrzymano mydło białe i miękkie. P/F a) b) 7 a) – F; Zadanie 12. b) – P; c) – F; d) – F [0-2 pkt.] Zapisz równanie reakcji jaka zaszła podczas ogrzewania obu substancji oraz równanie reakcji spalania kwasu stearynowego, w której jednym z produktów jest substancja prosta, która to występuje w każdym związku organicznym. temp. C17H35COOH + NaOH → C17H35COONa + H2O C17H35COOH + 8 O2 → 18 C + 18 H2O Zadanie 13. [0-2 pkt.] Spośród odpowiedzi A-J dobierz je tak, by utworzyły zdanie prawdziwe i wypisz litery poniżej: A Roztwór metyloaminy po dodaniu kilku kropel fenoloftaleiny Tłusta plama na spodniach C nie zabarwi się G podczas rozpuszczania amin w wodzie powstaje anion wodorotlenkowy. D barwi się na malinowo H metyloamina jest gazem nierozpuszczalnym w wodzie, podobnie jak metan. E łatwo usuwa się pod wpływem benzyny I tłuszcze są dobrze rozpuszczalne w niepolarnych rozpuszczalnikach. F trudno usuwa się pod wpływem benzyny J tłuszcze są dobrze rozpuszczalne w rozpuszczalnikach o budowie polarnej. B A – D, G Zadanie 14. ponieważ B – E, I [0-3 pkt.] Mając do dyspozycji dwie cząsteczki glicyny napisz równanie reakcji powstawania dwupeptydu na wzorach strukturalnych. Zaznacz wiązanie peptydowe oraz podaj nazwę tego dipeptydu (dwupeptydu). wiązanie peptydowe 8 ↑ H O │ ║ H-N-C– C–O–H + │ │ H H H O H O H O │ ║ │ ║ │ ║ H - N - C – C – O – H → H - N - C – C – N - C – C – O – H + H2O │ │ │ │ │ │ H H H H H H glicyloglicyna (Gly-Gly) Zadanie 15. [0-2 pkt.] Spośród wymienionych pierwiastków chemicznych wybierz odpowiednio te, które wchodzą w skład budowy podanych związków chemicznych i wpisz je do tabeli: S, C, Pb, N, Ag, H, Hg, O, P, J, Br Tłuszcze C, O, H Białka C, O, N, H, S, P Cukry C, O, H Zadanie 16. [0-2 pkt.] Ile podwójnych wiązań chemicznych występuje w trioleinianie glicerolu oraz jaka jest zawartość procentowa węgla w tym związku chemicznym? Liczba podwójnych wiązań chemicznych – 6 Zawartość procentowa węgla – 77,4 % Zadanie 17. [0-3 pkt.] Wymień 10 czynników wpływających na denaturację białka: 1 Ogrzewanie (podwyższona temperatura) 2 Silne mieszanie 3 Wstrząsanie 4 Naświetlanie nadfioletem 5 Naświetlanie promieniami rentgenowskimi 6 Naświetlanie promieniami jonizującymi 7 Działanie ultradźwiękami 8 Sole metali ciężkich 9 Mocne zasady 9 10 Mocne kwasy 11 Nisko cząsteczkowe alkohole 12 Aldehydy 13 Fenol 14 Prąd elektryczny Zadanie 18. [0-3 pkt.] Do każdej z probówek przedstawionych na schemacie dodano kilka kropel różnych substancji. kwas siarkowy (VI) kwas jodyna roztwór roztwór sacharozy glukozy azotowy (V) twaróg wodorotlenek jodyna kleik miedzi (II) mleko skrobiowy Uzupełnij powyższy tekst, aby zdania były prawdziwe. Zaznacz litery przyporządkowane odpowiednim wyrażeniom. Po dodaniu kolejno kilku kropel danych substancji do probówek zaobserwowano zmianę zabarwienia w probówkach: G / H / I / J / K. A / B / C / D / E zabarwienie pojawiło się w probówce V. Reakcje, które służą do wykrywania P / R / S / T zaszły w probówkach z L / Ł / M / N / O, to reakcje charakterystyczne. A. Różowofioletowe G. I L. roztworem cukru P. białka B. Żółte H. II Ł. roztworem glukozy R. sacharozy C. Czerwone I. III M. twarogiem S. skrobi D. Niebieskogranatowe J. IV N. kleikiem skrobiowym T. glukozy E. Brązowe K. V O. mlekiem F. Turkusowe Odp.: G, I, J, K, A, P, S, M, N, O. 10 Zadanie 19. [0-2 pkt.] Wskaż wszystkie fałszywe odpowiedzi wstawiając X obok. ❑A. Glukoza jest substratem reakcji fotosyntezy i fermentacji alkoholowej. ❑ B. Wszystkie kwasy organiczne ulegają dysocjacji elektrolitycznej. ❑C. Spożycie etanolu przez człowieka powoduje obniżenie ciśnienia krwi, rozszerzenie naczyń krwionośnych, obniżenie sprawności widzenia, przyśpieszenie tętna, odwodnienie organizmu. ❑D. Kwas propanowy i butanowy topnieją w temperaturze dodatniej bliskiej zeru. ❑E. Alkohole mają odczyn zasadowy, ponieważ podobnie jak wodorotlenki posiadają grupę OH. ❑ F. Glicerol stosuje się jako rozpuszczalnik. ❑G. Cząsteczka kwasu oleinowego zawiera w swojej budowie tyle atomów węgla, ile łącznie ma ich jedna cząsteczka sacharozy i fruktozy. Odp.: B, C, D, E Zadanie 20. [0-1 pkt] Dwuwartościowy pierwiastek tworzy siarczek o masie 1,4 razy większej od masy cząsteczkowej tlenku tego pierwiastka. Pierwiastkiem tym jest (obok wstaw X): ❑A. ❑ B. ❑C. ❑D. Zn Pb Ba Mg Odp.: D