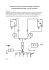Medyczne zastosowanie kriotechniki do przechowywania
Transkrypt
Medyczne zastosowanie kriotechniki do przechowywania
POLITECHNIKA GDAŃSKA WYDZIAŁ MECHANICZNY TECHNIKI NISKOTEMPERATUROWE W MEDYCYNIE Medyczne zastosowanie kriotechniki – do przechowywania preparatów biologicznych, w urządzeniach diagnostycznych i w kriochirurgii Opracowała: Anna Dawidowska IMM, stopień II Spis treści 1. Wstęp........................................................................................................................2 2. Przechowywanie preparatów biologicznych .............................................................2 3. Kriotechnika w urządzeniach diagnostycznych .........................................................6 4. Kriochirurgia .............................................................................................................7 4.1 Wiadomości ogólne ................................................................................................7 4.2 Zastosowanie ..........................................................................................................8 5. Bibliografia.............................................................................................................12 1|S tr o n a 1. Wstęp Kriotechnika to nauka zajmująca się badaniem i wykorzystaniem właściwości ciał w niskich temperaturach. Obecnie znalazła zastosowanie w wielu dziedzinach. W medycynie techniki niskotemperaturowe wykorzystuje się w leczeniu operacyjnym (kriochirurgia), rehabilitacji (krioterapia), transporcie preparatów biologicznych, a także pośrednio w diagnostyce medycznej. 2. Przechowywanie preparatów biologicznych W laboratoriach i szpitalach do przechowywania preparatów, próbek biologicznych wymagane są specjalne pojemniki, które zapewnią odpowiednie warunki. Najczęściej do przechowywania preparatów biologicznych wykorzystuje się ciekły azot oraz suchy lód. Są idealnymi środkami chłodzącymi podczas transportu i czasowego przechowywania preparatów biologicznych takich, jak: krew, tkanka lub narząd. Suchy lód jest tanim i powszechnie wykorzystywanym środkiem chłodzącym. Zestalony dwutlenek węgla w blokach można dość długo przechowywać w izolowanych styropianem i szczelnie zamkniętych pudłach, bez konieczności dodatkowego ich chłodzenia. Duże bloki suchego lodu o regularnych kształtach sublimują dość powoli. Np. blok o rozmiarach 1 dm 3 sublimuje w temperaturze pokojowej w zamkniętym pomieszczeniu ok 2-3 godzin. Zestalony dwutlenek węgla zapewnia nieprzerwane przez określony czas utrzymywanie temperatury w przedziale od +10°C do 25°C. Poza zdolnościami chłodniczymi CO2 posiada właściwości bakteriostatyczne. Przy dobrej izolacji pojemników suchy lód można w nich przechowywać przez wiele dni bez strat i zmian jego właściwości. Przykładowy pojemnik z suchym lodem przedstawia rys. 1 [5]. Rys. 1 Pojemnik chłodzony suchym lodem [5] Czysty azot wrze w temperaturze -195,8 °C w zależności od czystości i aktualnego ciśnienia atmosferycznego w zakresie 77–78 K, a ulega zestaleniu przy -210,0 °C (63,14 K). Na rynku wielu producentów oferuje pojemniki do przechowywania preparatów biologicznych chłodzonych ciekłym azotem, przykładowe znajdują się na rys. 2. Pojemniki zapewniają jednolite temperatury w całej zamrażarce od -1950C do -1900C [5]. Każdy z takich pojemników przeznaczony jest do przechowywania określonej ilości materiału biologicznego. 2|S tr o n a Rys. 2 Pojemniki o szerszej średnicy otworu wsadowego przeznaczone do przechowywania większych ilości materiału biologicznego [8] Pojemniki wyposażone są w systemy ułatwiające przechowywanie preparatów biologicznych. Na rys. 3 pokazany jest przykład w postaci 3-poziomowej karuzeli, która zapewnia wygodne sterowanie zapasami i maksymalizuje przestrzeń przechowywania. Rys. 3 System przechowywania materiału biologicznego [15] Rys. 4 Przechowywanie próbek biologicznych w ciekłym azocie Pojemniki tego typu wykorzystywane są w instytutach badawczych, laboratoriach biologicznych, placówkach sztucznego zapłodnienia, instytutach farmaceutycznych. Na rys. 5 jest zaprezentowany przykład takiego zastosowania. Jest to zdjęcie z laboratorium Polskiego Banku Komórek Macierzystych. Wyniki praktycznych doświadczeń wskazują, że nawet po kilkunastu latach 3|S tr o n a przechowywania komórek macierzystych w ciekłym azocie zachowują one takie same właściwości jak w momencie ich zamrożenia. Rys. 5 Laboratorium Polski Bank Komórek Macierzystych S.A [14] Pojemniki wykorzystujące techniki niskotemperaturowe znalazły również szerokie zastosowanie w transplantologii. Po pobraniu narządów od dawcy następuje okres, w którym narządy trzeba przechować poza organizmem w czasie transportu do ośrodka, gdzie wykona się przeszczepienie. W czasie przechowywania narządu między pobraniem a przeszczepieniem dąży się do maksymalnego spowolnienia umierania organu spowodowanego niedokrwieniem. Najważniejszą rzeczą spowalniającą metabolizm pobranego narządu, a tym samym łagodzącą skutki niedokrwienia, jest obniżenie jego temperatury (hipotermia). Najczęściej stosowaną metodą jest tzw. prosta hipotermia. Jeszcze w organizmie dawcy następuje usunięcie krwi z naczyń pobieranego organu poprzez przepłukanie ich zimnym roztworem prezerwacyjnym. Kolejne płukanie ma miejsce po pobraniu narządu, a następnie tak przygotowany organ umieszcza się w pojemniku wypełnionym wspomnianym płynem, w którym panuje stała temperatura ok. 0oC. Łatwość tej procedury, względnie niski koszt i zadowalające efekty czyni z prostej hipotermii metodę, którą stosuje się w większości przeszczepień serca, nerek, trzustki, wątroby lub płuc. W niektórych ośrodkach do prezerwacji nerek wykorzystuje się tzw. ciągłą perfuzję pulsacyjną w hipotermii. Polega ona na ciągłym przepompowywaniu płynu prezerwacyjnego przez łożysko naczyń nerkowych. W zależności od tego, z jakim narządem mamy do czynienia, wyróżniamy trzy rodzaje pojemników izotermicznych [7]: pojemniki izotermiczno-elektroniczne – przeznaczone do transportu nerek czy serc, czyli narządów, które w trakcie transportu wymagają stałej kontroli parametrów dokonywanej przez zespół czujników i analizowanych przez komputer. Urządzenia tego typu (rys. 6) są w związku z tym urządzeniami drogimi na rynku i ich używanie do transportu innych organów jest nieopłacalne ze względów finansowych. Pojemniki tego typu posiadają układ regulacji temperatury oraz możliwość zmiany takich parametrów, jak ciśnienie perfuzyjne, gęstość płynu konserwującego, czy inne parametry biochemiczne; 4|S tr o n a Rys. 6 Pojemnik izotermiczny firmy TransMedics [11] pojemniki izotermiczne do transportu narządów typu A – są to pojemniki do transportu narządów, takich jak wątroba i trzustka. Urządzenia tego typu (rys. 7 ) nie posiadają zwykle układu regulacji temperatury, a jedynie zapewniają temperaturę na wybranym poziomie (przeważnie 0-40C). W celu utrzymania niskiej temperatury w przestrzeni ładunkowej, w pojemnikach tego typu wykorzystuje się zazwyczaj suchy lód oraz rzadziej urządzenie sprężarkowe; Rys. 7 Pojemnik izotermiczny Kodiak [12] pojemniki izotermiczne do transportu narządów typu B – są to pojemniki (rys. 8) przeznaczone do transportu narządów, które wymagają przyszycia lub przeszczepienia powrotnego (palce, języki, czy też np. małżowina uszna). Warunki temperaturowe wymagane przez narządy tego typu sprawiają, iż urządzenia takie działają przeważnie w zakresach od -10 do 50C. Są to urządzenia uniwersalne posiadające możliwość regulacji temperatury przeważnie z dokładnością do 1 K, w zależności od rodzaju i wymagań narządu umieszczonego w środku. Rys. 8 Olivo Cold Logistic BAC 55 [10] 5|S tr o n a 3. Kriotechnika w urządzeniach diagnostycznych Pierwszym etapem leczenia jest diagnostyka, czyli rozpoznanie choroby na podstawie określonych badań. Współcześnie jedną z metod wykorzystujących technikę niskich temperatur, jest obrazowanie metodą rezonansu magnetycznego. To nieinwazyjna metoda uzyskiwania obrazów wnętrza obiektów. Zjawisko rezonansu magnetycznego polega na wykrywaniu protonów (jąder wodoru) w badanym narządzie. Silne pole elektromagnetyczne, wytwarzane przez magnes nadprzewodzący pobudza protony do wysyłania promieniowania elektromagnetycznego. Elektromagnesy z nadprzewodzącym uzwojeniem wytwarzać mogą bardzo stabilne pole magnetyczne o indukcji od 0,4[T] do 3[T] w dużym obszarze przestrzeni. Utrzymanie takiego silnego pola wymaga sporo energii, co jest realizowane przez nadprzewodnictwo, lub zmniejszenie oporu przewodów prawie do zera. Aby magnes stał się nadprzewodnikiem musi zostać schłodzony do temperatury około -270 oC. Takie chłodzenie zapewnia ciekły hel. Utrzymywanie uzwojenia w temperaturze ciekłego helu jest trudne i bardzo kosztowne. Stan nadprzewodzenia zwojów warunkuje prawidłową pracę elektromagnesu. Zwoje elektromagnesu zbudowane są z nadprzewodnika, stopu niobu z tytanem. Pierwsze aparaty MRI chłodzone ciekłym helem zużywały 0,4 l helu na godzinę. Do 2000 roku zużycie ciekłego helu zostało zmniejszone do mniej niż 0,03 l/h. W ostatniej dekadzie technologia „zero boil off” stała się standardem w systemach MRI. Rozwój chłodziarek kriogenicznych (Gifforda-McMahona) pozwala na konstrukcję magnesów, które chłodzone są jedynie poprzez kontakt cieplny z chłodziarką i w konsekwencji umożliwia budowę aparatów MRI, które nie będą wymagały okresowego uzupełniania ciekłego helu. System umożliwia odzyskanie odparowanego helu. Pozwala to na praktycznie nieograniczoną pracę układu (rys. 9) [5]. Rys. 9 Chłodzenie ciekłym helem w technologii „zero boil off” (po lewej), MRI Magnetom Verio firmy Siemens (po prawej) [17] Każdy aparat MRI przeciętnie potrzebuje 1700 l ciekłego helu. Zazwyczaj gęstość masowa ciekłego helu jest 1,25 kg / l, co w przybliżeniu oznacza, że MRI system potrzebuje ponad 2 ton ciekłego helu z 99,999% czystości [16]. 6|S tr o n a 4. Kriochirurgia 4.1 Wiadomości ogólne Kriochirurgia wykorzystuje zjawisko przerywania ciągłości tkanek w skutek zamrażania, w celu usunięcia lub zniszczenia chorej tkanki. Działanie niskich temperatur na poziomie komórki powoduje krystalizację wody wewnątrz- i zewnątrzkomórkowej, odwodnienie komórki, zwiększenie stężenia elektrolitów w jej wnętrzu oraz denaturację białek błony komórkowej. W tkance natomiast obserwuje się zwężanie drobnych naczyń tętniczych i żylnych z wtórnym zmniejszeniem wewnątrz kapilarnego ciśnienia hydrostatycznego i spadkiem przepływu krwi, zwiększenie przepuszczalności endotelium oraz zwiększenie lepkości krwi. W wyniku powstających zjawisk na obrzeżach zamrożonej tkanki naczynia ulegają znacznemu rozszerzeniu, co powoduje zaleganie krwi i nasila martwicę w obszarze zamrożenia. Kriochirurgia znalazła szerokie zastosowanie w dermatologii, onkologii, flebologii, gastrologii, kardiologii, laryngologii, okulistyce i ginekologii. W urządzeniach kriochirurgicznych, jako czynniki chłodnicze stosuje się skroplone gazy zwane cieczami kriogenicznymi. Są one bezpieczne w użyciu, niepalne i nieaktywne chemicznie. Najczęściej wykorzystywane to: ciekły azot o temperaturze wrzenia – 195,8o C; podtlenek azotu o temperaturze wrzenia – 88,7o C; dwutlenek węgla o temperaturze wrzenia – 78,9o C. Skuteczność destrukcji zależy od szybkości zamrożenia i rozmrażania tkanki. Po zamrożeniu i rozmrożeniu cytoplazmy komórki zahamowany jest jej metabolizm. W konsekwencji dochodzi do oddzielenia tkanki wymrożonej, głównie zmienionej chorobowo, od tkanki zdrowej. Podstawowym celem kriochirurgii jest zamrożenie takiej objętości tkanki, jaka musiałaby być wycięta podczas tradycyjnego wycięcia chirurgicznego. Wyróżniamy trzy metody zamrażania tkanek (rys. 10) [2]: 1. Metoda z użyciem wacika bawełnianego (deep steak) - polega na zamrożeniu tkanek za pomocą bawełnianego wacika zanurzonego w ciekłym azocie. W wyniku szybkiego odparowywania azotu z powierzchni wacika technika ta ma zastosowanie głównie w leczeniu płytkich, nienaciekających zmian, o charakterze nienowotworowym. Wadą metody jest ryzyko naciekania ciekłego azotu na skórę, co może spowodować uszkodzenie zdrowych tkanek otaczających zmianę chorobową. Kolejnym niekorzystnym efektem jest ryzyko przeniesienia zakażeń bakteryjnych przez azot (ten sam pojemnik ciekłego azotu i wielu pacjentów). Współczesną modyfikacją tej metody jest technika polegająca na stosowaniu jednorazowych wacików bawełnianych zakładanych na natryskową sondę aplikującą podtlenek azotu. Możliwość regulowania natężenia dopływu kriogenu pozwoliła zwiększyć precyzyjność zabiegu i zmniejszyła ryzyko niepotrzebnego uszkodzenia tkanek otaczających. 2. Metoda natryskowa – polega na rozpylaniu ciekłego azotu lub podtlenku azotu z odległości 0,5-1 cm na zmianę chorobową. Metoda jest szczególnie przydatna w kriochirurgii dużych powierzchni zmian skórnych. Jednak w dużym stopniu utrudnia 7|S tr o n a ocenę rzeczywistej strefy mrożenia, zwłaszcza w przypadku rozległych zmian, ponieważ w trakcie zabiegu część wcześniej mrożonego pola ulega rozmrożeniu. Wykwity o większych powierzchniach zamraża się pasmami, co umożliwia dokładniejszą kontrolę strefy mrożenia. W celu zwiększenia precyzyjności zabiegu możliwe jest stosowanie otwartych ograniczników w kształcie walców lub stożków o różnych średnicach, które zapobiegają rozprzestrzenianiu się pola zabiegu, wpływając na zwiększenie głębokości mrożenia. Precyzyjne wykonywanie zabiegu metodą natryskową wymaga stałego dopływu czynnika chłodzącego w trakcie całego cyklu mrożenia. 3. Metoda kontaktowa – polega na mrożeniu zmian skórnych za pomocą krioaplikatorów zamkniętych, schładzanych przepływającym w ich wnętrzu ciągłym strumieniem gazu. Dostępne jest wiele różnych krioaplikatorów, zwykle o okrągłej, płaskiej powierzchni przylegania. Czas zabiegu jest nieco dłuższy niż w przypadku techniki natryskowej, ale precyzyjność zabiegu, możliwość oceny strefy mrożenia i jego potencjalny zakres są znacznie większe. Metoda kontaktowa jest zalecana do leczenia głębokich, naciekających, guzowatych zmian. Uzyskaniu głębszej martwicy tą metodą sprzyja: nałożenie żelu obojętnego na skórę w miejscu zabiegu, oziębienie końcówki dopiero po jej przyłożeniu na skórę, anemizacja otoczenia poprzez wywieranie ucisku na aplikator lub dodatek noradrenaliny do znieczulenia. Rys. 10 Metody zamrażania tkanek: z użyciem bawełnianego wacika, natryskowa, kontaktowa 4.2 Zastosowanie Kriochirurgia jest często stosowaną metodą usuwania zmian patologicznych skóry i błon śluzowych. W dermatologii kriochirurgię stosujemy w leczeniu: łagodnych zmian skóry, stanów przedrakowych (np. leukoplakia, róg skórny), brodawek wirusowych (kurzajki), brodawek łojotokowych, plam soczewicowatych, rogowacenia posłonecznego, włókniaków, modzeli (odcisków), naczyniaków, bliznowców i przerosłych blizn, trądziku pospolitego i różowatego oraz wielu innych schorzeń dermatologicznych. Kolejną dziedziną medycyny gdzie znalazła zastosowanie kriochirurgia jest onkologia. Większość nowotworów skóry to niewielkie ogniska zwykle nieprzekraczające średnicy 2 cm i nienaciekające głębiej niż 4 mm. Do leczenia kwalifikują się nowotwory o różnym obrazie histologicznym. Kriochirurgia może być stosowana, jako jedyna metoda leczenia lub jako element terapii skojarzonej (kriochemioterapia). Coraz częściej tą metodą leczy się również nowotwory 8|S tr o n a wielu narządów wewnętrznych. Dzięki nowym metodom obrazowania kriochirurgiczne metody usuwania guzów są bardziej dokładne i pozwalają zmniejszyć rozległość zabiegu. Nową metodą jest przezskórna krioablacja sterowana rezonansem magnetycznym, podczas której dzięki użyciu MRI precyzyjnie umiejscawia się zmianę patologiczną i następnie steruje wymrażaniem guza. Daje to w efekcie małe rozmiary ubytku tkanki oraz możliwość zachowania funkcji fizjologicznej narządu. Tego typu zabiegi stosuje się przykładowo w guzach wątroby czy nerek. Krioablacja wykorzystywana jest również, jako metod leczenia zaburzeń rytmu serca. Krioablacja balonowa jest najnowszą metodę ablacji, stosowaną na świecie od kilku lat, w Polsce stosuje się od 2008 r (rys. 11). Lekarz wprowadza poprzez żyłę, najczęściej w okolicy pachwiny, specjalny cewnik do wnętrza serca i kieruje go na punkt odpowiedzialny za powstawanie zaburzeń rytmu. Do wnętrza cewnika wprowadzany jest czynnik chłodzący - podtlenek azotu, który celowo uszkadza obszar odpowiadający za zaburzenia rytmu serca. Miejsce to nie może już przewodzić impulsów elektrycznych, a przez to powodować arytmii. Krioablacja balonowa stosowana w migotaniu przedsionków pozwala jednym mrożeniem odizolować ogniska arytmii znajdujące się najczęściej w żyłach płucnych, czyli naczyniach prowadzących krew z płuc do lewego przedsionka serca. Rys. 11 Schemat obrazujący balon w ujściu żyły płucnej w czasie krioaplikacji. Mrożenie tkanek odbywa się w miejscu przylegania balonu [3] W okulistyce metody kriochirurgii wykorzystuje się najczęściej w leczeniu retinopatii. Niska temperatura powoduje wysiękowe zapalenie siatkówki i naczyniówki, które przez tworzenie zrostów wpływa na jej ponowne przyleganie. Kriopeksja jest obarczona mniejszym ryzykiem powikłań niż stosowana dotąd diatermiokoagulacja. Innymi schorzeniami, w których wykorzystuje się techniki niskich temperatur, to: chirurgia zaćmy, wirusowe schorzenia rogówki, powierzchowne blizny rogówki, zwyrodnienia rogówki, stany zapalne tęczówki i ciała rzęskowego, leczenie jaskry powikłanej, odwarstwienia siatkówki, krwotoki do komory przedniej i do ciała szklistego, oparzenia oczu. Przykładowe sondy krioaplikatorów pokazano na rys. 12. 9|S tr o n a Rys. 12 Zestaw sond stosowanych w okulistyce [13] W laryngologii szczególnie korzystnie kriochirurgia działa w przeroście małżowin nosowych wywołującym blokadę nosa. Nie jest istotne, czy blokada ta jest wynikiem reakcji alergicznej, czy infekcyjnej. Drugim po przeroście małżowin nosowych wskazaniem do kriochirurgii są krwawienia z małżowin nosowych dolnych, przegrody nosa jak i krwawienia z tylnej części nosa. Częstym wskazaniem do kriochirurgii jest przewlekłe przerostowe zapalenie migdałków podniebiennych (rys. 13). Ta jednostka chorobowa dobrze reaguje na zamrażanie. Zwykle wystarczają 2-3 sesje, po których następuje znaczne zmniejszenie migdałków podniebiennych oraz ustąpienie stanu zapalnego. Zastosowanie kriochirurgii hamuje proces zapalny i prowadzi do pełnej anatomicznej i funkcyjnej sprawności ustroju. Również procesy zapalne, nowotwory łagodne i stany przedrakowe błony śluzowej jamy ustnej i gardła mogą być skutecznie leczone za pomocą kriochirurgii. Rys. 13 Stan migdałków przed zabiegiem (po lewej) i po zabiegu kriochirurgicznym (po prawej) [6] Popularnym zabiegiem, z wykorzystaniem technik niskotemperaturowych jest kriochirurgiczne leczenie niewydolnych pni żylnych, tzw. kriostripping (rys. 14). Do zmienionego chorobowo odcinka żyły, poprzez kilka niewielkich (2-3 mm) nacięć wprowadza się specjalny krioaplikator wykorzystujący zjawisko adhezji. Gdy sonda dotrze do chorego miejsca, jej końcówka błyskawicznie zostaje schłodzona do temperatury minus 80-100°C. Fragment żyły przykleja się do niej i zostaje wyciągnięty na zewnątrz. W ten sposób, kawałeczek po kawałeczku, usuwa się główny pień żylny. Przez te same małe nacięcia można również usuwać odgałęzienia żylne. 10 | S t r o n a Rys. 14 Kriostripping [13] W porównaniu do tradycyjnych metod zabiegi kriochirurgiczne cieszą się coraz większą popularnością, wynika to z licznych zalet [17]: możliwość pełnego zniszczenia uprzednio wyznaczonej objętości tkanki, zarówno na powierzchni ciała, jak i wewnątrz każdego organu; dostęp do zmian patologicznych znajdujących się wewnątrz tkanki dzięki stosowaniu krioaplikatorów o małej średnicy; możliwość wielokrotnego zamrażania wznów po uprzednio prowadzonym leczeniu operacyjnym, radioterapii; występowanie jedynie minimalnego odczynu tkankowego wokół ogniska martwicy powstałej po zamrożeniu; zabieg przebiega praktycznie bez krwawień nawet w bogato unaczynionych narządach; możliwość wykonywania większości zabiegów ambulatoryjnie, ze względu na mało obciążający charakter; dobry efekt kosmetyczny; oddziaływaniem tylko na tkankę chorobowo zmienioną (w przypadku nowotworu: środki farmakologiczne- chemioterapia, inne formy leczenia – radioterapia oddziaływają na cały organizm); prosta technika zabiegu. Znajomość podstawowego zakresu wiedzy teoretycznej oraz nabycie doświadczenia w przeprowadzaniu zabiegów kriochirurgicznych pozwala wykorzystywać technikę kriochirurgii w leczeniu wielu rozmaitych stanów chorobowych. Z klinicznego punktu widzenia jest to metoda stosunkowo nieskomplikowana, wygodna i bezpieczna, a relatywnie niski koszt zakupu urządzeń i ich eksploatacji decyduje o tym, że jest ona atrakcyjna również z punktu widzenia ekonomicznego. 11 | S t r o n a 5. Bibliografia 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Janowski T.; Technologie nadprzewodnikowe i plazmowe w energetyce; Lubelskie Towarzystwo Naukowe; Lublin 2009; Toboła J., Witkowska A., Olsztyński A., Praktyczne uwagi na temat wybranych aspektów kriochirurgii zmian skórnych, Dermatologia Kliniczna 2004, 6; Koźluk E., Krioablacja balonowa u pacjenta z przetrwałym migotaniem przedsionków, Polski Przegląd Kardiologiczny 2008,10,2 170-175; Cieślar G., Sieroń A., Zastosowanie zimna w medycynie - kriochirurgia i krioterapia, AlfaMedica Press 2003; Podbielska H., Skrzek A., Zastosowanie niskich temperatur w medycynie, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 2012; www.limed.pl; Waszkiewicz Ł., Przechowywanie i transport narządów ludzkich przeznaczonych do przeszczepu, Technika Chłodnicza i Klimatyzacyjna, nr 5/2007; www.donserv.pl; Materiały firmy Siemens; www.en.olivo-logistics.com; www.transmedics.com; www.kernfrio.com; www.metrum.com; www.pbkm.pl; www.panasonic-biomedical.co.uk/index.htm; Reiser M., Hricak H., Semmler W., Magnetic Resonance Tomography, Springer 2008; Sieronia A., Cieślar G., Krioterapia-leczenie zimnem, Alfa-Medica Press 2007. 12 | S t r o n a